Projets
Les reins se réparent après aggression grâce à la prolifération des cellules épithéliales tubulaires. Cette réparation proliférative est physiologiquement auto-contrainte. En effet, l’expression précoce des inhibiteurs du cycle cellulaire p53 et p21 réduit la lésion initiale, ce qui suggère que l’arrêt transitoire du cycle cellulaire pourrait être bénéfique en cas de lésion rénale aiguë. Ces observations ont suscité le développement d’un projet à axes multiples, visant à (1) comprendre la relation entre la prolifération cellulaire et la production/dépense d’énergie, (2) les conséquences de cette relation dans les phases précoces et tardives suivant une aggression rénale aigue, et (3) évaluer comment la prolifération cellulaire pourrait être modulée afin de favoriser la réparation rénale et prévenir la transition de l’insuffisance rénale aigue (IRA) vers une maladie rénale chronique.
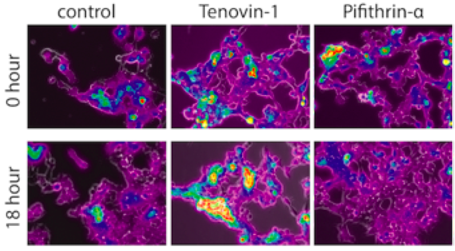
Nous avons précédemment identifié Nupr1 (Nulcear Protein 1) comme un gène de réponse précoce au stress, permettant une protection épithéliale dans un modèle de toxicité rénale aigue. NUPR1 exerce son effet rénoprotecteur pendant la phase précoce de l’IRA en empêchant une prolifération cellulaire et une dépense énergétique excessives dans l’épithélium tubulaire lésé.
En utilisant une combinaison de techniques de pointe in vivo et in vitro sur des modèles humains et animaux, nous poursuivons actuellement les projets suivants :
- L’administration de Nupr1 est-elle bénéfique pendant l’IRA ?
- Tester l’hypothèse de la prolifération dans l’effet délétère d’un prélèvement précoce sur la fonction du greffon rénal.
- Évaluation en temps réel de l’état métabolique du rein par des biomarqueurs non invasifs.
Publications
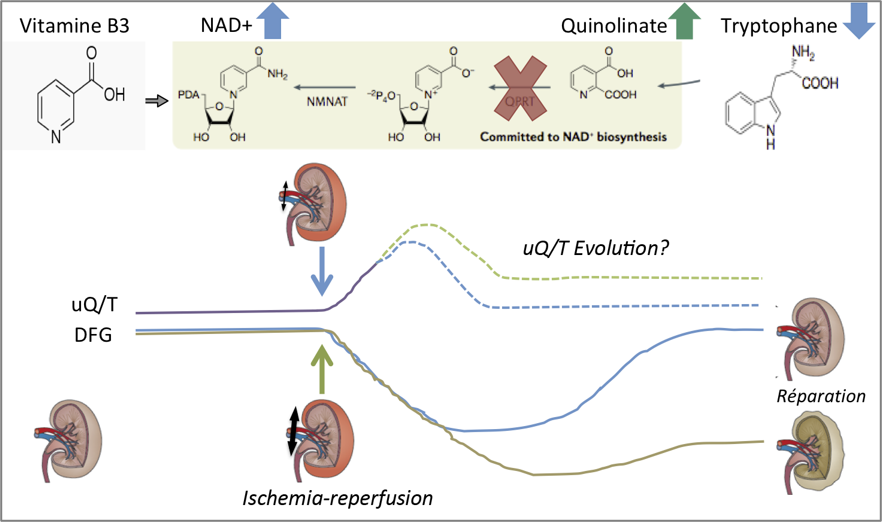
- Cell stress response impairs de novo NAD+ biosynthesis in the kidney. Bignon Y, Rinaldi A, Nadour Z, Poindessous V, Nemazanyy I, Lenoir O, Fohlen B, Weill-Raynal P, Hertig A, Karras A, Galichon P, Naesens M, Anglicheau D, Cippà PE, Pallet N. JCI Insight. 2021 Nov 18:e153019. doi: 10.1172/jci.insight.153019.
- Anaesthesia-Induced Transcriptomic Changes in the Context of Renal Ischemia Uncovered by the Use of a Novel Clamping Device. Verney C, Legouis D, Placier S, Migeon T, Bonnin P, Buob D, Hadchouel J, Galichon P. Int J Mol Sci. 2021 Sep 11;22(18):9840. doi: 10.3390/ijms22189840
- Altered proximal tubular cell glucose metabolism during acute kidney injury is associated with mortality. Legouis D, Ricksten SE, Faivre A, Verissimo T, Gariani K, Verney C, Galichon P, Berchtold L, Feraille E, Fernandez M, Placier S, Koppitch K, Hertig A, Martin PY, Naesens M, Pugin J, McMahon AP, Cippà PE, de Seigneux S. Nat Metab. 2020 Aug;2(8):732-743. doi: 10.1038/s42255-020-0238-1.
- Increased Fatty Acid Oxidation in Differentiated Proximal Tubular Cells Surviving a Reversible Episode of Acute Kidney Injury. Bataille A, Galichon P, Chelghoum N, Oumoussa BM, Ziliotis MJ, Sadia I, Vandermeersch S, Simon-Tillaux N, Legouis D, Cohen R, Xu-Dubois YC, Commereuc M, Rondeau E, Le Crom S, Hertig A. Cell Physiol Biochem. 2018;47(4):1338-1351. doi: 10.1159/000490819.
- Rapid Occurrence of Chronic Kidney Disease in Patients Experiencing Reversible Acute Kidney Injury after Cardiac Surgery. Legouis D, Galichon P, Bataille A, Chevret S, Provenchère S, Boutten A, Buklas D, Fellahi JL, Hanouz JL, Hertig A. Anesthesiology. 2017 Jan;126(1):39-46. doi: 10.1097/ALN.0000000000001400.
- Stress Response Gene Nupr1 Alleviates Cyclosporin A Nephrotoxicity In Vivo. Galichon P, Bataille A, Vandermeersch S, Wetzstein M, Xu-Dubois YC, Legouis D, Hertig A, Buob D, Placier S, Bigé N, Lefevre G, Jouanneau C, Martin C, Iovanna JL, Rondeau E. J Am Soc Nephrol. 2017 Feb;28(2):545-556. doi: 10.1681/ASN.2015080936.
